Materiale metallico
Da TecnoLogica.
|
Indice |
Descrizione
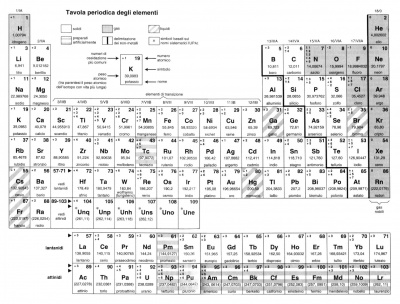
Si dicono metallici quei materiali costituiti principalmente da uno o più metalli, intendendo per metallo il gruppo di elementi chimici che si trovano sul lato sinistro della tavola periodica chimica.
Questi materiali, per quanto notevolmente eterogenei, hanno proprietà e caratteristiche comuni, quali:
- densità e punto di fusione abbastanza elevati;
- buona resistenza meccanica, duttilità e malleabilità;
- capacità di condurre calore e elettricità;
- elevata dilatazione termica;
- impermeabilità all'acqua e ridotta permeabilità al vapore;
- formazione ossidi se a contatto con l'ossigeno.
I metalli più utilizzati in edilizia sono:
- alluminio;
- cromo;
- ferro;
- nichel;
- piombo;
- rame;
- stagno;
- tungsteno;
- zinco.
Quando vengono utilizzati allo stato puro, i metalli vengono contraddistinti dal loro grado di purezza, espresso percentualmente. Ad esempio, Cu al 99% si riferisce ad un materiale metallico costituito da rame puro al 99%, e cioè caratterizzato da una frazione pari all'1% di impurità.
Altre volte, le impurità, o comunque altri materiali, vengono aggiunti allo scopo di migliorare alcune prestazioni dei metalli originari: questi, mischiati tra loro o anche con altri elementi non metallici, danno luogo alle leghe, che hanno caratteristiche anche profondamente diverse rispetto ai componenti di partenza, e vengono per questo motivo impiegate molto spesso nell'industria e nell'edilizia. Tra le leghe si hanno:
- acciaio al carbonio (ferro e carbonio);
- acciaio inox;
- bronzo;
- ghisa;
- leghe di alluminio
- ottone.
Caratteristiche
I metalli, e le leghe da essi composte, hanno delle configurazioni atomiche simili, e questo determina alcuni comportamenti affini.
In funzione dei meccanismi che vengono coinvolti, è possibile distinguere le caratteristiche chimiche da quelle fisiche.
Caratteristiche generali
I metalli e le leghe si presentano tutti, ad esclusione del mercurio, allo stato solido. A temperatura ambiente formano a livello atomico reticoli cristallini compatti e resistenti. Per tale motivo non è possibile distinguere ad occhio nudo alcuna presenza di grana, ed anzi appaiono alla vista omogenei.
La loro densità varia sensibilmente, ma è sempre superiore ai 2500 kg/m3, quindi abbastanza alta. La struttura cristallina li rende di fatto a porosità nulla, quindi impermeabili ai fluidi (e quindi con coduttività idraulica pari a zero). Anche la permeabilità al vapore è praticamente nulla, anche se si assume un valore di riferimento μ = 200000, a cui corrisponde una permeabilità di 0.000965 x 10-12 kg/msPa.
Anche la durezza varia notevolmente: i materiali più teneri, come l'alluminio puro, lo stagno ed il piombo, non superano 1.5 della scala di Mohs; zinco e argento raggiungono il grado di 2.5; rame (3.0) e ferro (4.0) si assestano su valori intermedi, mentre tungsteno (7.5) e cromo (8.5) raggiungono durezze decisamente elevate.
Sono materiali impermeabili all'acqua ed al vapore, anche se l'esposizione prolungata può deteriorarli notevolmente (→ Corrosione).
In genere sono estremamente duttili e malleabili, e questo consente loro di essere facilmente lavorati ed ottenere prodotti dalle forme più disparate.
| Nome | Composizione | Densità [kg/m3] | Fusione [°C] | Durezza [Mohs] | Porosità [%] | Permeabilità al vapore [kg/msPa x 10-12] | Conduttività idraulica [cm/s] |
|---|---|---|---|---|---|---|---|
| Acciaio al carbonio |
| 7860 | 1450÷1530 | 4 | 0 | 0.000965 | 0 |
| Acciaio COR-TEN |
| 7850 | 1500 | 4 | |||
| Acciaio inox |
| 7860 | 1450÷1530 | 4 | |||
| Alluminio | Metallo puro | 2700 | 658.7 | 1.5 | |||
| Alluminio (lega) |
| 2700 | 660 | 2 | |||
| Argento | Metallo puro | 10490 | 961.78 | 2.5 | |||
| Bronzo |
| 7400÷8900 | 900 | 2.5 | |||
| Cromo | Metallo puro | 7140 | 1857 | 8.5 | |||
| Ferro | Metallo puro | 7874 | 1535 | 4 | |||
| Ghisa |
| 7200 | 1160÷1300 | 3.5 | |||
| Nichel | Metallo puro | 8908 | 1455 | 4 | |||
| Ottone |
| 915÷955 | 900 | 2.5 | |||
| Piombo | Metallo puro | 11340 | 327.46 | 1.5 | |||
| Rame | Metallo puro | 8920 | 1084.6 | 3 | |||
| Stagno | Metallo puro | 7310 | 231.93 | 1.5 | |||
| Tungsteno | Metallo puro | 19250 | 3422 | 7.5 | |||
| Zinco | Metallo puro | 7140 | 419.52 | 2.5 |
In corsivo sono riportati i dati dedotti, e non ricavati direttamente dalla letteratura tecnica.
Esposizione al calore
I materiali metallici tendono a riscaldarsi ed a raffreddarsi velocemente perché hanno un calore specifico abbastanza basso (in media di 420 J/Kg K). Questo comporta una dilatazione ed un conseguente accorciamento abbastanza evidenti (per esempio, una barra di tungsteno di un metro, riscaldata di soli 20°C, si allunga di 6 mm).
Anche la capacità di trasmettere il calore è molto elevata, con valori di conducibilità termica che vanno da un minimo di 35.3 W/mK del piombo ad un massimo di 490 W/mK dell'argento.
In generale, l'esposizione al calore accelera le reazioni di corrosione, e rende i materiali metallici meno resistenti alle azioni meccaniche, soprattutto se si avvicina al loro punto di fusione.
Vista l'assoluta mancanza di porosità, i metalli non sono gelivi.
La seguente tabella riporta alcune proprietà relative all'esposizione al calore.
| Materiale | Punto di fusione [°C] | Calore specifico [J/kg K] | Dilatazione termica lineare [K-1] | Conduttività termica [W/mK] | Gelività |
|---|---|---|---|---|---|
| Acciaio al carbonio | 1450÷1530 | 460 | 0.000012 | 54 | Non gelivo |
| Acciaio inox | 1450÷1530 | 502 | 0.000017 | 16 ÷ 52 | |
| Alluminio | 658.7 | 897 | 0.000024 | 237 | |
| Alluminio (lega) | 550÷650 | 870 | 0.000023 | n.d. | |
| Argento | 961.78 | 232 | 0.000019 | 490 | |
| Bronzo | 900 | 380 | 0.000018 | 62 | |
| Cromo | 1857 | 450 | 0.000008 | 93.7 | |
| Ferro | 1535 | 440 | 0.000012 | 80.2 | |
| Ghisa | 1160÷1300 | 460 | 0.000011 | n.d. | |
| Nichel | 1455 | 440 | 0.000013 | 90.7 | |
| Ottone | 900 | 377 | 0.000019 | 111 | |
| Piombo | 327.46 | 129 | 0.000029 | 35.3 | |
| Rame | 1084.6 | 385 | 0.000017 | 390 | |
| Stagno | 231.93 | 228 | 0.000027 | 66.6 | |
| Tungsteno | 3422 | 130 | 0.000005 | 174 | |
| Zinco | 419.52 | 390 | 0.000031 | 116 |
Esposizione ai campi elettromagnetici
I metalli sono caratterizzati da una scarsissima resistività elettrica, e di conseguenza, da una elevata conduttività. Questa proprietà varia da metallo a metallo: il cromo ha il valore più elevato (77.4 x 106 Siemens / metro), seguito dall'argento (63.0 x 106 S/m), ma per la realizzazione di conduttori elettrici viene preferito il rame (59.6 x 106 S/m) e, più raramente, l'alluminio (37.7 x 106 S/m) grazie alla loro elevata duttilità.
Decisamente scarsa è la conduttività elettrica della ghisa (0.83 x 106 S/m), a causa dell'elevata presenza di carbonio in questa lega.
L'esposizione ai campi magnetici genera invece comportamenti diversi; si distinguono i materiali feromagnetici, che vengono fortemente attratti da calamite ed elettrocalamite, e materiali paramagnetici e diamagnetici che invece non lo sono. Il comportamento dei metalli è comunque molto sensibile alla temperatura: è possibile infatti determinare per ognuno di essi la temperatura di Curie, cioè un valore al di sotto del quale il metallo è ferromagnetico e al di sopra smette di esserlo.
La seguente tabella riporta i valori di conduttività elettrica e il comportamento ai campi magnetici riferiti alle condizioni standard (15°C)[1].
| Materiale | Conduttività elettrica x 106[S/m] | Comportamento ai campi magnetici |
|---|---|---|
| Acciaio al carbonio | 1,40÷6,85 | Ferromagnetico |
| Acciaio inox | 1,40÷6,85 | Diamagnetico |
| Alluminio | 37.7 | Paramagnetico |
| Alluminio (lega) | 37.7 | Paramagnetico |
| Argento | 63.0 | Diamagnetico |
| Bronzo | 14.3 | non ferromagnetico |
| Cromo | 77.4 | Paramagnetico |
| Ferro | 9.96 | Ferromagnetico |
| Ghisa | 0.83 | Ferromagnetico |
| Nichel | 14.3 | Ferromagnetico |
| Ottone | 15.9 | non ferromagnetico |
| Piombo | 4.81 | Diamagnetico |
| Rame | 59.6 | Diamagnetico |
| Stagno | 9.17 | non ferromagnetico |
| Tungsteno | 18.9 | Paramagnetico |
| Zinco | 16.6 | Diamagnetico |
Esposizione alle sollecitazioni meccaniche
I metalli puri e le leghe sono caratterizzati da reticoli cristallini molto resistenti, in grado quindi di assorbire tensioni estremamente elevate prima di giungere a rottura.
In generale, i materiali metallici sono caratterizzati da:
- isotropia, cioè reagiscono allo stesso modo indifferentemente dalla direzione di sollecitazione;
- uguale resistenza alla trazione ed alla compressione (ad eccezione della ghisa)
- tensione di rottura molto elevata (in media di 350 MPa)
- tratto elastico quasi lineare, con moduli di elasticità longitudinale elevati (in media 120 GPa);
- comportamento plastico incrudente, cioè che migliora la resistenza in fase plastica (ad esclusione della ghisa lamellare e degli acciai armonici, che hanno un comportamento fragile);
- grande tenacità, cioè la capacità di assorbire energia prima di rompersi;
- duttilità, ovvero la possibilità di subire grandi deformazioni plastiche dovute alla trazione;
- malleabilità, cioè la capacità di essere deformata facilmente a compressione.
Mentre la malleabilità è una caratteristica di tutti i metalli, la duttilità è maggiore in quelli molto tenaci (oro, platino, argento) rispetto a quelli meno tenaci (stagno, piombo)[2].
La seguente tavola raccoglie le principali proprietà meccaniche dei diversi materiali.
| Materiale | Tensione di rottura [MPa] | Modulo di elasticità longitudinale [GPa] |
|---|---|---|
| Acciaio al carbonio | 360÷530 | 206 |
| Acciaio inox | 500÷825 | 206 |
| Alluminio | 220 | 70 |
| Alluminio (lega) | 124÷590 | 69÷76 |
| Argento | n.d. | 73 |
| Bronzo | 350 | 113 |
| Cromo | n.d. | n.d. |
| Ferro | 360 | 190 |
| Ghisa | +250 ÷ +700 -900 ÷ -1150[3] | 120 |
| Nichel | n.d. | 180÷214 |
| Ottone | 210 | 100 |
| Piombo | 25 | 14 |
| Rame | 200 | 122 |
| Stagno | 35 | 40 |
| Tungsteno | n.d. | 400 |
| Zinco | 100 | 95 |
Grazie al comportamento incrudente, molti metalli possono subire deformazioni plastiche permanenti in grado di renderli più resistenti alle sollecitazioni meccaniche. Per tale motivo possono subire diverse lavorazioni a freddo, quali l'estrusione, l'imbutitura, la laminazione, la pallinatura, la placcatura, lo stampaggio, e la trafilatura.
Per la loro caratteristica fisica, i metalli perdono facilmente le loro proprietà meccaniche a crescere della temperatura. Questo, nelle strutture metalliche, costringe i progettisti a fornire un'adeguata protezione antincendio, che si ottiene o inserendo le parti metalliche all'interno di carterature protettive (ad esempio, pannelli in cartongesso REI), o eseguendo cicli di verniciatura intumescente.
Corrosione
Un fenomeno comune a tutti i metalli è quello della corrosione, cioè della predisposizione ad essere attaccati da agenti corrosivi che reagiscono chimicamente dando luogo a sostanze dalle caratteristiche profondamente differenti rispetto al metallo di partenza.
Nonostante esistano meccanismi differenti, i fenomeni corrosivi sono caratterizzati dal fatto che gli atomi di metallo cedono elettroni, ossidandosi. Gli atomi di metallo così ossidati possono disciogliersi in una soluzione, oppure ricombinarsi con atomi di ossigeno dando luogo ad un ossido, o legarsi ad un atomo non metallico generando un sale.
La propensione di un materiale metallico ad essere corroso dipende quindi dalla facilità con la quale i metalli cedono elettroni: tale caratteristica è detta nobilità. In altri termini, più un materiale è nobile meno esso tende naturalmente a cedere elettroni, e quindi a corrodersi. Di seguito si riporta un elenco di materiali metallici, dal meno al più nobile:
- Litio
- Sodio
- Magnesio
- Titanio
- Alluminio
- Manganese
- Zinco
- Cromo
- Ferro, acciaio al carbonio, ghisa
- Cadmio
- Nichel
- Stagno
- Piombo
- Rame
- Acciaio inossidabile
- Argento
- Mercurio
- Platino
- Oro.
Metalli poco nobili quindi si ossidano con facilità, ed è il motivo per cui in natura non vengono rinvenuti allo stato puro, ma sempre combinati con altri elementi chimici. Metalli molto nobili si corrodono con estrema lentezza e, allo stato puro, tendono a mantenersi inalterati per tempi anche molto lunghi. La velocità di corrosione però non dipende esclusivamente dalla nobiltà, ma anche dalla forma data al materiale: un pezzo di ferro di si corrode meno velocemente di quanto accade alla polvere di ferro della stessa quantità, perché la superficie a contatto con l'esterno è nel secondo caso di gran lunga superiore al primo.
A seconda del metallo e del tipo di corrosione, il fenomeno può proseguire nel tempo - fino al completo deterioramento - o arrestarsi. Nel primo caso, il prodotto della corrosione risulta avere un peso specifico maggiore rispetto al metallo corroso: questo comporta che il materiale ossidato, dovendo occupare lo stesso volume del metallo di partenza, o risulta essere molto poroso o si raggrinzisce fratturandosi. In entrambe le situazioni, il materiale sottostante, ancora intatto, viene esposto all'aggressione dell'agente, ed il processo si itera. È questo il caso della ruggine (ossidi di ferro), che si sfalda permettendo l'ulteriore degrado del ferro (o dell'acciaio al carbonio) sottostante, fino alla completa scomparsa del materiale iniziale. Nel secondo caso, il prodotto della corrosione ha un peso specifico maggiore, e quindi si presenta come una pellicola estremamente compatta e fortemente aderente al materiale sottostante, proteggendolo da ulteriori attacchi. Questo fenomeno, detto passivazione, blocca la corrosione arrestandola allo stato iniziale.
Metalli e leghe che di passivano naturalmente sono il rame, l'alluminio e l'acciaio inossidabile (quest'ultimo, a causa dell'aggiunta di cromo e nichel rispetto al normale acciaio al carbonio, forma uno strato protettivo di Cr2O3); ferro, acciaio al carbonio e ghisa sono invece soggetti ad una corrosione continua.
Per evitare il fenomeno, sono oggi disponibili diverse lavorazioni, tutte aventi come scopo quello di creare una pellicola superficiale protettiva che abbia caratteristiche di resistenza e di impermeabilità. Tra queste si annoverano:
- la passivazione e l'anodizzazione;
- la galvanizzazione, ed in particolare la zincatura;
- la placcatura, ed in special modo la ramatura, nichelatura e cromatura;
- la fosfatazione, soprattutto usata per la ghisa;
- la verniciatura antiruggine .
Esposizione all'ossigeno e all'acqua
Il tipo di corrosione più comune è quello che si verifica esponendo il materiale all'ossigeno, e quindi a tutte le sostanze che lo contengono. Comunemente ciò avviene quando il metallo è immerso in aria o in acqua, ed è quindi praticamente sempre presente nelle normali condizioni di utilizzo. La reazione che avviene può essere semplicemente schematizzata come:
M + O → Ossido di M,
dove M è il generico metallo attaccato, e O l'ossigeno.
Nel caso estremamente frequente del ferro e dell'acciaio al carbonio, le reazioni sono molteplici, in funzione della presenza di acqua e/o dell'ossigeno allo stato di gas:
3Fe + 4H2O → Fe3O4 + 4H2
2Fe + O2 + 2H2O → 2Fe(OH)2
4Fe + 3O2 + 6H2O → 4Fe(OH)3
4Fe + 3O2 + 2H2O → 2Fe2O3•H2O
6Fe + 4O2 → 2Fe3O4.
La reazione di ossidazione del metallo aumenta (si estende e si velocizza) con l'aumentare della temperatura. L'azione di corrosione è generalizzata, cioè estesa all'intera superficie esposta.
Esposizione agli acidi (atmosfere aggressive)
Gli acidi inorganici che possono giungere a contatto con i metalli in condizioni di utilizzo sono di due tipi:
- gli idracidi, costituiti da idrogeno (H) e un non metallo (X) o un gruppo non metallico (lo ione cianuro);
- gli ossiacidi, costituiti da idrogeno (H), ossigeno (O) ed un non metallo (X).
In entrambi i casi, il contatto con un metallo M genera una reazione chimica schematizzabile come:
M + HX → M+ + X- + H
M + HOX → M+ + OX- + H
Se l'acido è in soluzione acquosa, lo ione M+ si solubilizza nell'acqua, e il metallo si discioglie. L'azione di corrosione è generalizzata, cioè estesa all'intera superficie esposta.
La passivazione chimica è un processo che può ridurre la dissoluzione dovuta agli acidi, soprattutto quando l'ossido che si forma è particolarmente impermeabile[4].
Esposizione alla galvanizzazione
Quando due materiali metallici con diversa nobiltà (predisposizione a cedere elettroni) sono posti vicini ed immersi in un elemento fluido conduttore di elettricità (detto elettrolita), come ad esempio l'aria umida o l'acqua, viene a crearsi un sistema elettrico detto cella galvanica (sul cui principio si basa l'invenzione della pila) per il quale si crea un flusso di elettroni da un metallo all'altro. In particolare, il metallo avente nobiltà inferiore perde elettroni, cedendoli spontaneamente all'elettrolita, che li trasporta e li deposita sull'altro metallo. Il primo metallo quindi si ossida, e cioè si corrode, mentre il secondo si riduce, cioè acquista elettroni e di conseguenza non si ossida. Questo fenomeno può essere schematizzato come:
M1+ → e- + M2,
dove M1 è il metallo a nobiltà inferiore che si ossida, M2 è quello a nobiltà superiore, e e- è l'elettrone trasferito. Il fenomeno è tanto maggiore quanto elevata è la differenza di nobiltà dei due metalli.
Un esempio tipico di corrosione galvanica (o corrosione per contatto galvanico) è quella che avviene negli infissi in alluminio (metallo che si ossida) ed il ferro o una sua lega, di cui sono costituite le viti e altre componenti, e che obbliga i produttori a proteggere i profili anodizzandoli.
Esposizione ai cloruri (atmosfere marine)
La presenza di cloruri, cioè di ioni di cloro Cl- (costituenti fondamentali del sale marino, NaCl) innesca in alcuni punti un meccanismo elettrochimico per il quale lo strato di ossido passivante presente a protezione di un materiale metallico si disgrega perché lo ione metallico presente nell'ossido si lega con quello di cloro, liberando ossigeno. In termini generali avviene che:
Cl- + MO → ClM + O
dove M è il generico metallo, e MO è l'ossido metallico protettivo dovuto alla passivazione. Questo processo rende corrodibili anche quei metalli e quelle leghe metalliche che si passivano naturalmente, come l'alluminio e l'acciaio inossidabile, oltre ad attaccare i materiali già esposti all'ossidazione continua (ferro, ghisa, acciaio al carbonio).
Questo tipo di disgregazione è localizzata, e prende il nome di corrosione per vaiolatura o corrosione per pitting (in inglese, pitting = vaiolatura), perché si manifesta con una serie di buchi sulla superficie dell'oggetto.
Il meccanismo corrosivo è complesso: le aree attaccate dal cloruro, di solito ristrette ad alcuni punti, vengono depassivate, cioè private dello strato protettivo. Questo provoca in superficie la presenza di ossidi ancora passivanti, che circondano aree depassivate; queste ultime hanno una maggiore predisposizione a cedere elettroni rispetto al contorno, e quindi fungono da anodi in un processo di corrosione galvanica localizzata, che si manifesta con l'apertura di crateri di ossidazione sempre più profondi, tali da comportare anche la foratura passante nel metallo.
Il fenomeno è responsabile della corrosione dei ferri di armatura del calcestruzzo, perché in esso possono facilmente penetrare gli ioni di cloro.
Lavorazioni
Grazie alle loro caratteristiche, i materiali metallici possono essere lavorati grazie a processi meccanici, termici ed elettrici.
Formatura
La formatura dei pezzi può essere realizzata in diversi modi.
La fusione consiste nel rendere liquido il materiale e nel versarlo in stampi, permettendo di far assumere la forma voluta. Successivamente il fluido si raffredda e si solidifica; può quindi essere estratto dallo stampo e subire i successivi processi di lavorazione. La fusione, infatti, restituisce un pezzo grezzo e con diverse sbavature, che devono essere eliminate. La fusione permette di ottenere oggetti anche di grandi dimensioni, ma che devono successivamente essere sgrossati e rettificati (sabbiatura).
La pressofusione permette di iniettare negli stampi (conchiglie) il materiale ad una pressione molto elevata (tra i 140 e i 1400 bar), permettendo di ottenere oggetti molto precisi e dalle forme estremamente articolate. Anche in questo caso l'oggetto che si ottiene deve essere lavorato per eliminare sbavature, ma il prodotto finito è in grado di rispettare tolleranze anche dell'ordine di 1/10 mm. La pressofusione è decisamente più costosa della fusione; è una lavorazione esclusivamente industriale (mentre la fusione può, in un certo senso, essere realizzata anche per via semiartigianale) e non è in grado di produrre oggetti di notevoli dimensioni.
Quando il materiale grezzo è di una forma non molto dissimile dal pezzo che si vuole ottenere, è possibile sagomarlo attraverso la forgiatura, consistente nel riscaldare il metallo per renderlo più lavorabile (ma mantenendosi al di sotto del punto di fusione) per conformarlo tramite martellatura o stampaggio. Anche se sottoposti a notevoli sbalzi termici e stress meccanici, i metalli mantengono pressoché inalterate le loro caratteristiche. Se il raffreddamento del prodotto finito avviene immergendolo in acqua fredda, si ottiene un metallo temperato, cioè un metallo a cui si è data la tempra: questo permette di avere materiali più resistenti alle sollecitazioni meccaniche.
La laminazione è una lavorazione che può essere eseguita tanto a caldo quanto a freddo, e consiste nell'ottenere una lamina metallica, cioè una piastra di spessore molto piccolo, realizzata facendo passare il pezzo grezzo (di solito una piastra, ottenuta per fusione) attraverso due cilindri ravvicinati. Diminuendo progressivamente la distanza si ottengono prodotti dello spessore sempre più ridotto. Gli spessori vengono di solito espressi in decimi di millimetro: una lamina da 20/10, ad esempio, misura 2 mm di spessore.
Realizzata quasi sempre a freddo è la trafilatura, un processo che consiste nel far attraversare il materiale grezzo, ma delle dimensioni quasi simili al prodotto che si vuole ottenere, attraverso una trafila, cioè un foro calibrato a tronco di cono che permette la riduzione dell'oggetto alla forma voluta. È utilizzata nella produzione di tubi, tondi e fili metallici, che vengono appunto detti trafilati. Sono caratterizzati da una grande precisione dimensionale ed un'ottima finitura superficiale.
Spesso i prodotti metallici utilizzati in edilizia vengono detti profilati, perché la loro caratteristica morfologica distintiva è, appunto, il profilo della sezione trasversale, essendo questi prodotti in travi o sbarre di lunghezza variabile; questi semilavorati sono ottenuti in diversi modi: tubi, barre e fili sono realizzabili tramite profilatura; elementi piatti possono essere prodotti grazie alla laminazione; profili complessi a doppio T, ad L, a C, possono essere invece ottenuti per estrusione, cioè costringendo il materiale entro una matrice che lo conforma nel modo voluto. Sono necessarie potenti presse idrauliche che azionano mandrini pressatori, in grado di imprimere la pressione sufficiente a procurare le deformazioni plastiche nel materiale informe (massello).
La produzione di oggetti concavi a partire da lamine metalliche si ottiene con una lavorazione detta imbutitura, cioè un insieme di stampaggio e tornitura grazie ai quali è possibile ottenere prodotti finiti mantenendo inalterato lo spessore di partenza.
Il processo di formatura può prevedere anche lavorazioni per asportazione di truciolo, dove l'oggetto viene scolpito da macchinari in grado di consumare le parti in eccesso, trasformandole appunto in trucioli: sono la fresatura e la tornitura.
Trattamento superficiale
Il trattamento superficiale può avere due scopi principali: protettivo o estetico. In entrambi i casi la superficie deve essere preventivamente trattata, pulendola (decapaggio) attraverso processi meccanici (sabbiatura, smerigliatura), chimici o elettrochimici (fresatura elettrochimica). Successivamente, è possibile ricoprire il metallo con:
- un ossido stabile, allo scopo di impedirne la corrosione;
- un metallo nobile, allo scopo di impedirne la corrosione e/o conferire un aspetto pregiato;
- un metallo avente un ossido stabile;
- una vernice, avente lo scopo di aumentare la resistenza al fuoco vernice intumescente;
- una pittura, con il fine di conferire un colore ed un aspetto voluti.
La formazione di ossido sulla superficie di un materiale metallico è detta passivazione, e può essere provocata:
- verniciando il materiale con una vernice antiruggine, che deposita un ossido di piombo (minio, di colore rosso-arancione) o di ferro (di colore grigio scuro);
- elettrochimicamente, immergendo il materiale in una cella elettrolitica (anodizzazione);
- chimicamente, utilizzando una vernice passivante o immergendo il pezzo in acido fosforico (fosfatazione).
La verniciatura antiruggine è indicata per quei semilavorati che devono successivamente essere pitturati, in quanto fornisce anche una superficie più aggrappante per la pittura stessa, rendendola più durevole nel tempo. L'ossido di ferro, non contenendo piombo, è un prodotto più sicuro per la salute, e dovrebbe essere per questo preferito al minio di piombo (che però è più efficace).
L'anodizzazione, molto utilizzata per l'alluminio, serve per proteggere il metallo dalla corrosione galvanica, e non dalla normale ossidazione dovuta all'esposizione all'aria, contro la quale l'alluminio è già sufficientemente nobile da risultare inattaccabile. Trattamenti particolari permettono la realizzazione anche di anodizzazioni colorate.
La fosfatazione è una lavorazione molto spesso impiegata per proteggere prodotti destinati all'uso all'aperto, come le opere stradali in ghisa (chiusini, caditoie, grigliati), che permette anche di rendere più scabra la superficie, e meglio adatta ad essere pitturata o verniciata.
La pittura passivante è invece molto spesso impiegata quando occorre ripristinare opere metalliche deteriorate, come accade per i ferri di armatura immersi nel calcestruzzo, permettendo anche di trasformare la ruggine presente in ossidi di ferro più resistenti (convertitori di ruggine).
La realizzazione di uno strato protettivo costituito da un metallo nobile (in grado di ossidarsi con molta lentezza) o da un metallo dotato di un ossido compatto avviene per placcatura e per galvanizzazione. Questa lavorazione dovrebbe essere riservata a pezzi che non devono essere successivamente tagliati o saldati, perché questo comporta la perdita dello strato protettivo e l'impossibilità di poterlo ricostruire se non in officina. Inoltre, questa lavorazione dovrebbe essere riservata ai semilavorati che non devono essere successivamente pitturati: per questi dovrebbe essere preferito un trattamento di vernice antiruggine, che permette il migliore ancoraggio della pittura fungendo anche da primer. Cicli di pittura su metallo senza la preparazione dell'antiruggine sono destinati a spellicolare in breve tempo.
La placcatura è una lavorazione di tipo meccanico, dove il metallo di apporto viene fissato sul metallo di base tramite pressione, ottenendo un preaccoppiato grazie al quale vengono poi realizzati lamiere, tubi, nastri, ed altri semilavorati.
La galvanizzazione può avvenire in due modi: a caldo e a freddo.
La galvanizzazione a caldo consiste nell'immergere il pezzo in un bagno di metallo fuso, ricoprendolo completamente. Grazie alle alte temperature del bagno galvanico la superficie dell'oggetto si fonde parzialmente, combinandosi con il metallo protettivo. Questo conferisce allo strato superficiale un'ottima presa, rendendolo solidale al metallo di base.
La galvanizzazione a freddo, o galvanostegia, è ottenuta per via elettrolitica, e permette di ricoprire il pezzo da lavorare con una pellicola sottilissima, anche dell'ordine di millesimi di millimetro. È molto utilizzata per i metalli preziosi (argento e oro), ma anche per ottenere finiture molto precise (cromatura, nichelatura).
Indipendentemente dal processo (placcatura o galvanizzazione), la ricopertura metallica è spesso indicata con il nome del metallo di apporto. Si hanno in particolare: argentatura, doratura e ottonatura a scopo principalmente ornamentale; cromatura a scopo sia ornamentale, per la finitura a specchio che si ottiene, che protettivo (ad esempio, la cromatura di oggetti di uso comune e la rubinetteria); nichelatura, ramatura, stagnatura e zincatura a scopo protettivo.
Nelle carpenterie metalliche è molto utilizzata la zincatura a caldo - cioè ottenuta per galvanizzazione a caldo - per le strutture destinate all'aperto, tanto che spesso i termini zincatura e galvanizzazione sono considerati, erroneamente, sinonimi.
Giunzioni
I metodi per congiungere due o più elementi metallici sono diversi, e hanno applicazioni distinte.
Se le parti da unire fanno parte di strutture metalliche, i principali modi sono per saldatura, per bullonatura e per chiodatura.
Le saldature permettono di avere dei pezzi perfettamente collegati, ma devono essere realizzate con grande cura per evitare che siano presenti delle imperfezioni; per tale motivo, le saldature dovrebbero essere realizzate in officina ed evitare quelle in cantiere, che sono quasi sempre di minore pregio.
Per le parti che devono essere unite in cantiere si preferiscono quindi la chiodatura e la bullonatura.
Rispetto alla chiodatura, la bullonatura presenta due vantaggi importanti: consente di smontare rapidamente la struttura svitando i dadi (al contrario, la chiodatura impone il taglio della testa del chiodo), e permette di realizzare anche resistenze ad attrito (e non solo a taglio) se si utilizzano speciali bulloni ed il serraggio avviene con una chiave dinamometrica.
Quando si utilizzano lamiere e laminati in genere, i carichi che la giunzione deve sopportare sono sempre inferiori rispetto a quelli che portano i profiliati metallici; per tale motivo chiodi e bulloni sarebbero sovradimensionati, mentre la saldatura non è consigliabile perché, visto il ridotto spessore della lamina, è possibile danneggiare l'elemento da congiungere fondendolo irrimediabilmente. In tal caso si può utilizzare la rivettatura come valida soluzione.
Nel caso di giunzioni non strutturali, spesso la saldatura è la lavorazione più utilizzata, anche se in alcune parti i punti di saldatura restano visibili.
Con lo sviluppo di prodotti chimici sempre più performanti, sono oggi reperibili in commercio numerosi adesivi per eseguire l'incollaggio di parti in metallo tra loro e/o con altri materiali. Si tratta di resine epossidiche di grande resistenza ma il cui costo ne permette l'impiego solo per quantitativi contenuti.
Voci correlate
- Bullonatura
- Chiodatura
- Decapaggio
- Duttilità
- Estrusione
- Fresatura
- Forgiatura
- Fosfatazione
- Fusione
- Galvanizzazione
- Galvanostegia
- Imbutitura
- Laminazione
- Malleabilità
- Pitturazione
- Placcatura
- Plasticità
- Pressofusione
- Rivettatura
- Sabbiatura
- Saldatura
- Smerigliatura
- Stampaggio
- Tempra
- Tenacità
- Trafilatura
- Verniciatura
Note
- ↑ Per i metalli contrassegnati con la dicitura non ferromagnetico non è stato possibile recuperare se il comportamento è diamagnetico o paramagnetico
- ↑ Cfr. Luigi Vitiello, Oreficeria moderna, Hoepli Editore, pag.36.
- ↑ La ghisa ha diverse resistenze a trazione (valori positivi) e a compressione (valori negativi)
- ↑ «…il ferro, il cobalto, il nichel, il cromo ecc. si ossidano, passivandosi, se immersi in acido nitrico concentrato o in permanganato o anche in acido cromico ecc.; i metalli così trattati non sono più capaci di disciogliersi negli acidi, né di spostare cationi più nobili dalle loro soluzioni, né di solubilizzarsi, se funzionanti da anodi in una cella elettrolitica».Voce passivazione dell'Enciclopedia on line Treccani.
|