Idrolisi
Da TecnoLogica.
m (Ha protetto "Idrolisi" ([edit=autoconfirmed] (infinito) [move=autoconfirmed] (infinito))) |
|||
| Riga 1: | Riga 1: | ||
==Descrizione== | ==Descrizione== | ||
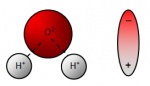
[[File:acqua dipolo.jpg | 150px| thumb | right |Molecola d'acqua]] | [[File:acqua dipolo.jpg | 150px| thumb | right |Molecola d'acqua]] | ||
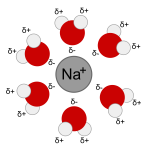
| - | [[File:Na+H2O.png | 150px | thumb | right | Ione sodio immerso in acqua]] | + | [[File:Na+H2O.png | 150px | thumb | right | [[Ione]] sodio immerso in acqua]] |
Reazione chimica ([[Abbreviazioni (aiuto)|''pron.'']] idròlisi) per la quale una molecola viene scissa in due se immersa in acqua.<br/> | Reazione chimica ([[Abbreviazioni (aiuto)|''pron.'']] idròlisi) per la quale una molecola viene scissa in due se immersa in acqua.<br/> | ||
Versione attuale delle 18:06, 3 dic 2019
Descrizione
Reazione chimica (pron. idròlisi) per la quale una molecola viene scissa in due se immersa in acqua.
Spesso l'idrolisi è una reazione che avviene durante la solvatazione, cioè l'interazione tra solvente e soluto che genera una soluzione.
Le molecole di acqua possono essere immaginate come un dipolo elettromagnetico, cioè come una calamita microscopica dotata di un polo negativo (l'atomo di ossigeno) ed uno positivo (la coppia di atomi di idrogeno). Se la capacità di attrazione di questo dipolo supera quella che tiene insieme gli atomi della molecola, quest'ultima si divide in due parti, di cui una ha uno squilibrio di cariche elettriche negative, e l'altra ha uno squilibrio di cariche positive.
Come risultato, le parti positive vengono attorniate dai dipoli rivolti dal lato negativo, mentre le parti negative vengono invece circondate dalle molecole d'acqua dal lato positivo degli atomi di idrogeno.
I sali (un atomo metallico unito con un non metallo) subiscono l'idrolisi se immersi in acqua.
Numerosi minerali possono subire l'idrolisi allo stato naturale: sulla loro superficie sono molto spesso presenti dei cationi metallici (atomi caricati positivamente) che, per imperfezioni dei reticoli cristallini, non sono stati saturati elettricamente; in altre parole, questi atomi sono disponibili a formare dei legami chimici se incontrano molecole polarizzate. Se tali metalli non sono legati fortemente con la molecola di origine, abbandonano la superficie dando inizio ad una reazione a catena (la loro assenza rende disponibili altri atomi non saturati elettricamente) che porta - con la giusta quantità di acqua e il tempo necessario - fino alla completa dissoluzione del materiale.
L'idrolisi non deve essere confusa con l'idratazione, dove non avviene la scissione della molecola.
Voci correlate
|